산업
'선진입 의료기술' 안전성 높이고 '환자 선택권' 강화
- 입력 2024.10.28 12:00


정부가 새로운 의료기술의 시장 진입을 넓혀 현장 사용을 우선 허용하고, 이후 안전성과 유효성을 평가하는 선진입제도를 확대한다.

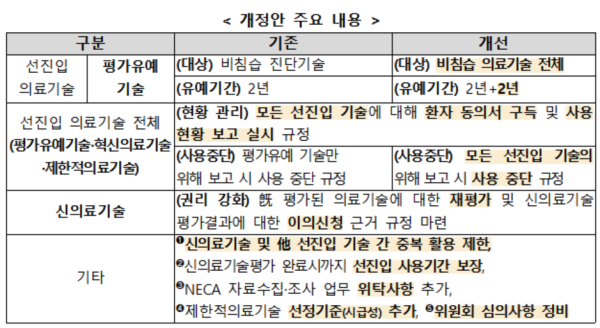
보건복지부는 선진입 의료기술의 안전관리 강화, 신의료기술의 재평가 근거 규정 마련, 평가유예 기술 기간 연장 등의 내용을 담은 '신의료기술평가에 관한 규칙' 일부개정안을 12월9일까지 입법예고한다고 28일 밝혔다.
복지부는 그동안 신의료기술평가 선진입 제도를 지속적으로 개선해 뛰어난 의료기술을 환자 치료에 조기 활용할 수 있도록 해왔다. 하지만 신의료기술평가가 완료되지 않은 선진입 기술의 특성상 사용 중 안전성 관리를 강화하고 충분한 임상 근거를 창출하기 위해 선진입 기간(평가유예 2년)을 확대해야 한다는 의견이 꾸준히 제기돼 왔다.
이에 복지부는 지난해부터 ▲바이오헬스 신시장 창출 전략 회의 ▲규제혁신전략회의 등에서 발굴한 혁신방안과 ▲선진입-후평가 제도개선 공청회에서 논의된 내용 등을 반영, 선진입 기술의 안전성 강화와 기업의 시장진입 활성화를 동시에 달성하기 위한 규칙 개정을 추진하기로 했다.
개정안은 선진입 기술 사용 시 환자 동의서와 사용현황 보고를 의무사항으로 규정해 안전관리 체계를 강화한다. 또 평가위원회에서 위해 수준이 높다고 보고한 선진입 기술은 사용중단 조치해 안전성에 문제 있는 기술은 퇴출하도록 했다. 의료기술의 안전성에 우려가 있거나 유효성이 변경되는 경우를 대비해 의료기술의 재평가 근거 조항을 마련하고, 기술의 유용성·가치에 대한 주기적인 관리도 추진한다.
이와 함께 선진입 기술의 시장 진입을 활성화하기 위해 평가유예 대상을 비침습 의료기술 전체로 확대했다. 또 평가유예기술 사용기간을 최대 4년(1회 연장)까지 연장하고, 신의료기술평가를 신청 중인 선진입 의료기술은 결과가 나올 때까지 지속 사용할 수 있도록 해 연속적인 임상 활용을 지원하기로 했다.
김국일 복지부 보건의료정책관은 "2022년 '신의료기술평가에 관한 규칙' 개정 이후 의료계·산업계·시민단체 등이 제기한 의견과 현장의 애로사항을 반영해 이번 제도개선안을 마련했다"며 "선진입 의료기술의 안전성 관리를 강화하면서도 우수한 기술을 시장에서 신속하게 활용할 수 있게 될 것"이라고 기대했다.
개정안의 자세한 내용은 복지부 홈페이지→정보→법령→ 입법/행정예고 전자공청회에서 확인할 수 있으며 관련 의견은 12월9일까지 복지부 의료자원정책과로 제출하면 된다.
조인경 기자 ikjo@asiae.co.kr
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제(www.asiae.co.kr) 무단전재 배포금지>

보건복지부는 선진입 의료기술의 안전관리 강화, 신의료기술의 재평가 근거 규정 마련, 평가유예 기술 기간 연장 등의 내용을 담은 '신의료기술평가에 관한 규칙' 일부개정안을 12월9일까지 입법예고한다고 28일 밝혔다.
복지부는 그동안 신의료기술평가 선진입 제도를 지속적으로 개선해 뛰어난 의료기술을 환자 치료에 조기 활용할 수 있도록 해왔다. 하지만 신의료기술평가가 완료되지 않은 선진입 기술의 특성상 사용 중 안전성 관리를 강화하고 충분한 임상 근거를 창출하기 위해 선진입 기간(평가유예 2년)을 확대해야 한다는 의견이 꾸준히 제기돼 왔다.
이에 복지부는 지난해부터 ▲바이오헬스 신시장 창출 전략 회의 ▲규제혁신전략회의 등에서 발굴한 혁신방안과 ▲선진입-후평가 제도개선 공청회에서 논의된 내용 등을 반영, 선진입 기술의 안전성 강화와 기업의 시장진입 활성화를 동시에 달성하기 위한 규칙 개정을 추진하기로 했다.
개정안은 선진입 기술 사용 시 환자 동의서와 사용현황 보고를 의무사항으로 규정해 안전관리 체계를 강화한다. 또 평가위원회에서 위해 수준이 높다고 보고한 선진입 기술은 사용중단 조치해 안전성에 문제 있는 기술은 퇴출하도록 했다. 의료기술의 안전성에 우려가 있거나 유효성이 변경되는 경우를 대비해 의료기술의 재평가 근거 조항을 마련하고, 기술의 유용성·가치에 대한 주기적인 관리도 추진한다.
이와 함께 선진입 기술의 시장 진입을 활성화하기 위해 평가유예 대상을 비침습 의료기술 전체로 확대했다. 또 평가유예기술 사용기간을 최대 4년(1회 연장)까지 연장하고, 신의료기술평가를 신청 중인 선진입 의료기술은 결과가 나올 때까지 지속 사용할 수 있도록 해 연속적인 임상 활용을 지원하기로 했다.

김국일 복지부 보건의료정책관은 "2022년 '신의료기술평가에 관한 규칙' 개정 이후 의료계·산업계·시민단체 등이 제기한 의견과 현장의 애로사항을 반영해 이번 제도개선안을 마련했다"며 "선진입 의료기술의 안전성 관리를 강화하면서도 우수한 기술을 시장에서 신속하게 활용할 수 있게 될 것"이라고 기대했다.
개정안의 자세한 내용은 복지부 홈페이지→정보→법령→ 입법/행정예고 전자공청회에서 확인할 수 있으며 관련 의견은 12월9일까지 복지부 의료자원정책과로 제출하면 된다.
조인경 기자 ikjo@asiae.co.kr
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제(www.asiae.co.kr) 무단전재 배포금지>
- #시장
- #환자
- #안전
- #기술
- #사용
- #선택
- #강화
- #선진
- #의료
- #평가
이 기사, 어떠셨나요?
- 기뻐요
- 0
- 응원해요
- 0
- 실망이에요
- 0
- 슬퍼요
- 0
산업 주요뉴스
- 1
- [르포] '전기 SUV 경연' LA 오토쇼…현대차·기아, 초반 관심 몰이(종합)
![[르포] '전기 SUV 경연' LA 오토쇼…현대차·기아, 초반 관심 몰이(종합)](https://cdn.inappnews.net/news/560602/ian-1732260007-541826.jpg)
- 2
- LGU+ "AI 통화비서 '익시오', 다운로드 10만건 넘어"

- 3
- "다음 AI 격전지는 모바일"…AI업계, 휴대폰 제조사에 러브콜

- 4
- '현대차 CEO 내정' 무뇨스 "美 규제에 준비됐다…유연하게 조정"(종합)

- 5
- 제주 올레길서 자립을 꿈꾸는 고립·은둔 청년들

- 6
- 1∼10월 지방공항 국제선여객 1천500만명 넘어…코로나 전 89%로

- 7
- 파나시아, 암모니아 기반 청정에너지 기술 개발 업무 협력

- 8
- 티앤씨재단, 홀로코스트 현장 탐방 기록 다큐멘터리 공개

- 9
- 이스타항공, 재운항 20개월 만에 누적 탑승객 600만명 넘어

- 10
- 한국타이어, 한국노총 노조와 임금협상 타결…임금 6% 인상




 5개
5개



최신순
추천순
답글순

등록된 댓글이 없습니다.0/500